여러분 안녕하세요~! ProsED U쏘t입니다.나는 많은 학생들이 공부하는데 어려움을 느끼는 화학2의 내용을 쉽고 간단하게 설명하는 이해할 수 있는 화학2 시리즈를 진행하고 있습니다. 알기 쉬운 화학 2, 이번에는 소금의 가수 분해에 대해 자세히 알아보도록 하겠습니다.소금이란? 소금은 산과 염기의 중화 반응에 의해 생기는 화합물입니다. 중화반응으로 산의 음이온과 염기의 양이온이 결합하여 생성된 이온결합물을 소금이라고 합니다.


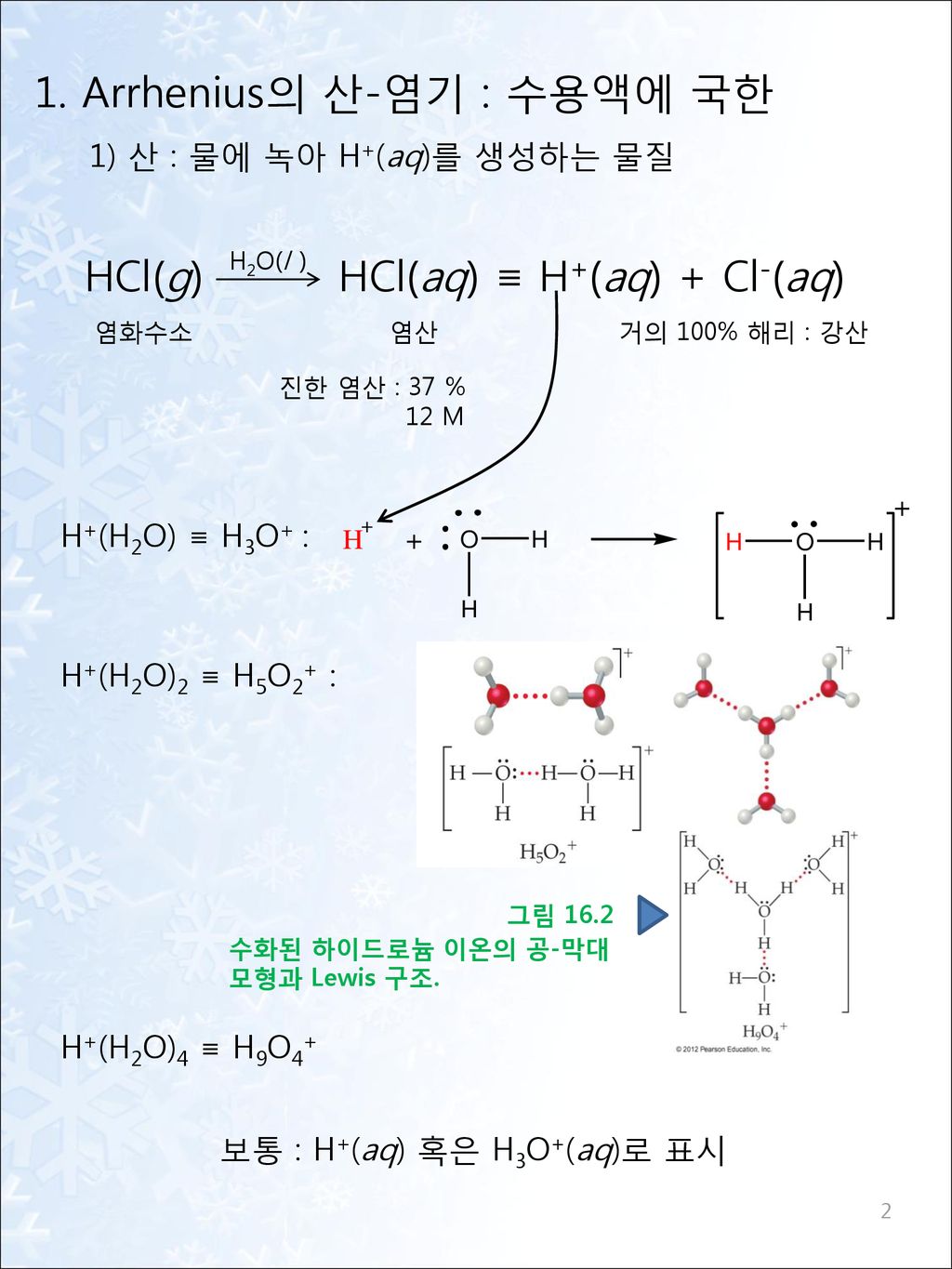
중화반응 (출처: http://hssci.co.kr/) 소금의 종류에는 3가지가 있습니다. 산성염, 염기성염, 중성염이 있습니다. 각각에 대해서 자세히 알아보겠습니다.
- 산성염산염이란 산의 가수가 염기의 가수보다 클 경우 산의 H+이온이 남아있는 소금입니다. 가장 대표적인 산성염 반응은 다음과 같습니다.2. 염기성 염기성 소금은 염기의 OH-가 남아있는 소금입니다. 산의 가수보다 염기의 가수가 클 때 발생하며 대표적인 염기성 염반응의 예는 다음과 같습니다.3. 중성염(정염) 중성염은 H+나 OH-가 없는 소금으로 산의 가수와 염기의 수가 같을 때 소금을 중성염 혹은 정염이라고 합니다.소금의 가수분해산과 염기가 반응하여 소금과 물을 생성하는 반응이 중화반응이라면 소금과 물이 반응하여 다시 산 또는 염기를 생성하는 반응을 가수분해라고 합니다. 지난 번 알기 쉬운 화학 2 시리즈에서 본 중화점에서의 pH 기억하시나요? 강산과 강염기의 경우 중화점 pH가 7이 되지만 강염기와 약산 혹은 강산과 약염기의 중화반응에서의 pH는 7이 아니라는 것을 확인할 수 있었습니다. 이러한 현상은 가수분해에 의해 발생합니다. 즉, 약산과 약염기의 중화반응으로 생성된 소금은 가수분해를 하지만 강산과 강염기의 중화반응으로 생성된 소금은 가수분해를 하지 않기 때문에 발생합니다.(참고:화학2에서 대표적인 강산은 HCl, H2SO4, HNO3, 강염기는 NaOH, Ca(OH)2, KOH, Ba(OH)2가 있습니다.)
먼저 강산과 약염기의 중화반응을 살펴보겠습니다.
위 그림과 같이 강산과 약염기 중화반응의 경우 중화점 pH는 7보다 작은 산성을 보여줍니다. 이 반응을 자세히 살펴보겠습니다. 상기 그래프의 반응은 염산과 암모니아수의 중화반응으로 다음과 같이 나타낼 수 있습니다.중화반응 후 NH4+와 Cl-이온이 생깁니다. 이때 강산의 대염기인 Cl-는 가수분해를 하지 않기 때문에 이 두 이온 중 가수분해를 하는 것은 NH4+이온 중 하나입니다. 가수분해는 이 약염기의 젖산과 물이 결합하여 이루어집니다. 이 반응을 나타내면 다음과 같이 표현할 수 있습니다.이렇게 중화적정이 완료된 중화점에서 약염기 짝수 분해를 해서 H+이온을 생성하기 때문에 약염기와 강산의 중화반응에서 중화점의 pH는 7보다 작아집니다.
다음으로 약산과 강염기의 중화반응을 살펴보겠습니다.
위 그림과 같이 약산과 강염기 중화반응의 경우 중화점 pH는 7보다 큰 염기성을 보여줍니다. 위 그래프의 반응은 아세트산과 수산화나트륨의 중화반응으로 다음과 같이 나타낼 수 있습니다.중화반응 후 CH3COO-와 Na+이온이 발생합니다. 이때 강염기의 대산인 Na+는 가수분해를 하지 않기 때문에 이 두 이온 중 가수분해를 하는 것은 CH3COO-이온 중 하나입니다. 가수분해는 이 약산의 대염기와 물이 결합해서 하게 됩니다. 이 반응을 나타내면 다음과 같이 표현할 수 있습니다.이렇게 중화 적정이 완료된 중화점에서 약산 짝수 분해를 해서 OH-이온을 생성하기 때문에 약산과 강염기 중화반응에서 중화점 pH는 7보다 커집니다.
지금까지 화학2에서 배우는 산염기 평형 중염의 가수분해에 대해 자세히 알아봤습니다.다음 시간에는 지금까지 살펴본 산염기평형에 대한 평가원의 문제를 함께 풀어보도록 하겠습니다.
지금까지 ProsEDU 소트였습니다~!

#프로스에듀 #티처스 #화상과외 #화상과외플랫폼 #영어과외 #수학과외 #과학과외 #명문대과외